Reacciones endotermicas y exotermicas.
Reacción Exotérmica.
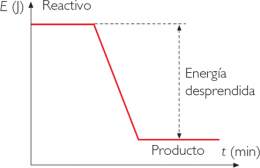
Es aquella reacción donde se libera calor, esto significa que la energía de las moléculas de los productos (EP) es menor que la energía de las moléculas de los reaccionantes (ER). En las reacciones químicas exotérmicas se desprende calor, el DH es negativo y significa que la energía de los productos es menor que la energía de los reactivos, por ejemplo en las reacciones de combustión.urante las reacciones químicas puede producirse absorción o liberación de energía. Esto indica que tanto los reaccionantes como los productos contienen calor que es característico de su masa. El contenido de calor es una medida de la energía que está acumulada por una sustancia durante su formación. La combustión del metano es una reacción de tipo exotérmico: CH4(g) + 2O2(g) CO2(g) + 2H2O(g) + 213 Kcal.
Energía calorífica y temperatura: Si una muestra de agua a una temperatura conocida (Temperatura inicial = Ti) se calienta durante un cierto tiempo, se observa un incremento de su temperatura. Al medir la nueva temperatura se obtiene la Temperatura final (Tf), la variación de la temperatura en la muestra se calcula restando la Tf menos la Ti y el resultado se denomina T.
Reacciones endotérmicas.
 Son aquellas que absorben energía en forma de calor. Una vez que la energía total se conserva del primer para el segundo miembro de cualquier reacción química, si una reacción es endotérmica, la entalpía de los productos Hp es mayor que la entalpía de los reactivos Hr , pues una determinada cantidad de energía fue absorbida por los reactivos en forma de calor, durante la reacción, quedando contenida en los productos. Siendo que en la reacción endotérmica: Hp > Hr.
Son aquellas que absorben energía en forma de calor. Una vez que la energía total se conserva del primer para el segundo miembro de cualquier reacción química, si una reacción es endotérmica, la entalpía de los productos Hp es mayor que la entalpía de los reactivos Hr , pues una determinada cantidad de energía fue absorbida por los reactivos en forma de calor, durante la reacción, quedando contenida en los productos. Siendo que en la reacción endotérmica: Hp > Hr.
Y siendo DH = Hp — Hr , entonces en la reacción endotérmica el valor de ΔH será siempre positivo. Siendo que en la reacción endotérmica: ΔH > 0.
La reacción produce nitrato de bario, amoníaco y agua… y absorbe gran cantidad de calor, tanto que congela la capa de agua que queda sobre la madera y la “pega” al matraz. Ba(OH)2.8H2O + 2 NH4NO3 → Ba (NO3)2 + 2 NH3 + 10 H2O ∆H= 80,3 KJ. En esta reacción hay un gran aumento de entropía: pasamos de 3 moles a 13 moles y de sustancias en fase sólida a sustancias en disolución. Este aumento de entropía hace que el proceso sea espontáneo, aunque la variación de entalpía del proceso no sea favorable. La espontaneidad de una reacción química viene dada por la variación de la energía libre de Gibbs. Las reacciones endotérmicas, sobre todo las del amoníaco impulsaron una próspera industria de generación de hielo a principios del siglo XIX.
Reacciones Exotérmica.
Es aquella reacción donde se libera calor, esto significa que la energía de las moléculas de los productos (EP) es menor que la energía de las moléculas de los reaccionantes (ER). En las reacciones químicas exotérmicas se desprende calor, el DH es negativo y significa que la energía de los productos es menor que la energía de los reactivos, por ejemplo en las reacciones de combustión.
Comentarios
Publicar un comentario