Ruptura de enlaces químicos.
Balancear una ecuación significa que debe existir una equivalencia entre el numero de los reactivos y el numero de los productos. Para ello existen distintos métodos como: balanceo correcto hay que considerar lo siguiente la suma de la masa de las sustancias reaccionantes debe de ser igual a la suma de las masas de productos. Cualquier método requiere conocer la Ley de la conservación de la materia de Lavoiser, la materia no se crea ni se destruye, solo se transforma.
1.-Balancear primero metales o no metales
2.-Balancear en segundo termino los oxígenos
3.-Considerar por ultimo el hidrógenoCasi todas las reacciones químicas implican la ruptura y formación de los enlaces que unen los átomos. Normalmente, la ruptura de enlaces requiere un aporte de energía, mientras que la formación de enlaces nuevos desprende energía. Si la energía desprendida en la formación de enlaces es menor que la requerida para la ruptura, entonces se necesita un aporte energético, en general en forma de calor, para obtener los productos.Una reacción química consiste en un nuevo reagrupamiento de los átomos de los reactivos para formar los productos. Esto supone la ruptura de ciertos enlaces y la formación de otros nuevos. Si se conociesen las energías de estos enlaces, se podría calcular fácilmente la entalpía de reacción.
Se llama energía de enlace a la energía necesaria para romper un mol de dichos enlaces.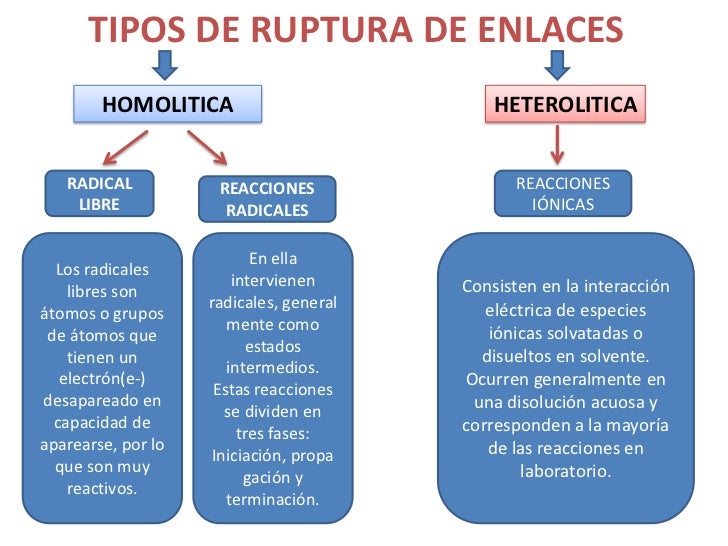
2.-Balancear en segundo termino los oxígenos
3.-Considerar por ultimo el hidrógenoCasi todas las reacciones químicas implican la ruptura y formación de los enlaces que unen los átomos. Normalmente, la ruptura de enlaces requiere un aporte de energía, mientras que la formación de enlaces nuevos desprende energía. Si la energía desprendida en la formación de enlaces es menor que la requerida para la ruptura, entonces se necesita un aporte energético, en general en forma de calor, para obtener los productos.Una reacción química consiste en un nuevo reagrupamiento de los átomos de los reactivos para formar los productos. Esto supone la ruptura de ciertos enlaces y la formación de otros nuevos. Si se conociesen las energías de estos enlaces, se podría calcular fácilmente la entalpía de reacción.
Se llama energía de enlace a la energía necesaria para romper un mol de dichos enlaces.

Comentarios
Publicar un comentario